Cepat-Cepat Ingin Vaksin Corona
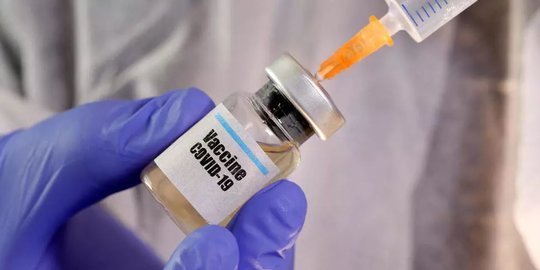
Merdeka.com - Keberadaan vaksin corona memberikan secercah harapan. Beragam jenis merek vaksin digadang-gadang segera masuk Indonesia. Pemerintah bahkan menargetkan November ini jutaan vaksin bakal disuntikkan. Kemudian diundur dan belum ada kepastian lagi.
Keputusan ini menjadi tanda tanya besar. Tanpa menjelaskan alasan, pemerintah hanya optimis vaksin segera hadir. Padahal salah satu vaksin corona jenis Sinovac masih dalam tahap uji klinis. Vaksin asal China yang diteliti Fakultas Kedokteran Universitas Padjadjaran bersama Biofarma ini ditargetkan selesai uji klinis tahap ke-3 selesai pada Januari 2021.
Ketua Tim Peneliti Uji Klinis Vaksin Covid-19 dari Fakultas Kedokteran Universitas Padjadjaran, Prof. Kusnandi Rusmil mengatakan, sebuah vaksin tidak bisa segera digunakan secara masif meski dinyatakan lolos uji klinis. Perlu waktu hingga hasil benar-benar meyakinkan. Untuk itu Sinovac diprediksi baru terealisasi pada Maret 2021.
-
Kenapa negara termiskin kesulitan beli vaksin? Ini terlepas fakta bahwa negara termiskin juga berjuang untuk membeli dan meluncurkan vaksin COVID-19 untuk melawan pandemi.
-
Kenapa vaksin dalam negeri penting? Hal ini disampaikannya saat meresmikan fasilitas produksi vaksin PT Biotis Pharmaceuticals Indonesia di Kabupaten Bogor, pada Rabu (11/9). Menkes Budi menekankan bahwa pengalaman sukses dalam mengembangkan Vaksin Merah Putih menunjukkan betapa krusialnya memiliki berbagai jenis vaksin untuk memastikan keamanan kesehatan masyarakat.
-
Apa tujuan produksi vaksin dalam negeri? Kemandirian dalam produksi vaksin merupakan salah satu kebijakan utama Kementerian Kesehatan (Kemenkes) dalam meningkatkan ketahanan kesehatan nasional.
-
Kenapa anak harus divaksinasi? Vaksinasi atau imunisasi adalah langkah penting dalam menjaga kesehatan anak-anak kita.
-
Kenapa vaksin Mpox diizinkan di Indonesia? Penggunaan vaksin Mpox di Indonesia kini telah mendapat persetujuan dari Organisasi Kesehatan Dunia (WHO) dan Badan Pengawas Obat dan Makanan (BPOM) RI, yang menunjukkan bahwa vaksin ini aman dan dapat digunakan dalam kondisi darurat kesehatan.
-
Bagaimana cara meningkatkan ketahanan kesehatan melalui vaksin? Menkes Budi juga menambahkan, untuk mendukung ketahanan kesehatan, diperlukan penelitian yang berkelanjutan dan mengikuti perkembangan teknologi. Pemerintah melalui berbagai program terus mendorong pengembangan vaksin berbasis teknologi terkini.
Adapun jangka waktu 6 bulan uji klinis fase III vaksin sinovac merupakan jangka waktu ideal. Pembahasan ini juga disetujui Biofarma dan Sinovac. Sebagai pihak yang melakukan uji klinis, timnya patuh pada pengaturan jangka waktu yang demikian. "Selesai semuanya bulan Maret (2021). Jadi saya tinggal ikutin saja." kata dia kepada merdeka.com, Kamis pekan lalu.
Hingga sekarang, sudah ada sudah sudah ada 1.620 relawan yang disuntik. Proses penyuntikan sendiri dijadwalkan akan terjadi dua kali. Suntikan pertama sudah dilakukan di awal masa uji klinis. Sekarang pihaknya sedang menjalankan proses penyuntikan tahap kedua. Proses penyuntikan tahap kedua pun sudah hampir selesai. Sebab sudah dilakukan pada pada 1.500-an relawan. Pekan ini, ditargetkan proses penyuntikan tahap kedua sudah selesai.
Dalam proses uji klinis dijalankan Kusnadi dan tim, dikabarkan pula bahwa rombongan pemerintah Indonesia bertolak ke China untuk memastikan ketersediaan vaksin. Rombongan Kementerian Kesehatan, BPOM, dan Biofarma, itu mendatangi tiga produsen vaksin di antaranya Cansino, G42/Sinopharm dan Sinovac. Mereka dikabarkan mencari vaksin yang siap edar untuk November ini.
Ketiga perusahaan tersebut sudah masuk tahap akhir dalam uji klinis. Pada tahap ketiga ini tengah dalam proses mendapatkan Emergency Use Authorization (EUA) di sejumlah negara. Cansino melakukan uji klinis tahap ke-3 di Tiongkok, Arab Saudi, Rusia dan Pakistan.
Perusahaan G42/Sinopharm melakukan uji klinis tahap ke-3 di China, Uni Emirat Arab (UEA), Peru, Maroko dan Argentina. Sedangkan Sinovac melakukan uji klinis tahap ke-3 di Tiongkok, Indonesia, Brazil, Turki, Banglades, dan Chile.
Ketiga perusahaan ini pun telah mendapatkan Emergency Use Authorization dari Pemerintah Tiongkok pada Juli 2020 lalu. Tiap perusahaan pun memiliki kapasitas produksi yang berbeda. Alasan itu membuat pemerintah Indonesia yakin November segera memberikan vaksin.
Cansino menyanggupi 100 ribu vaksin untuk single dose atau satu kali vaksinasi per orang di bulan November 2020, dan sekitar 15-20 juta untuk tahun 2021. Kemudian G42/Sinopharm menyanggupi 15 juta dosis vaksin untuk dual dose (dua kali vaksinasi per orang) tahun ini, lalu 5 juta dosis akan mulai datang pada bulan November 2020. Sementara itu Sinovac menyanggupi 3 juta dosis vaksin hingga akhir Desember 2020. Komitmen pengiriman 1,5 juta dosis vaksin untuk single dose vials pada pekan pertama November.
Lalu 1,5 juta dosis vaksin untuk single dose vials selanjutnya pada minggu pertama Desember 2020 dan ditambah 15 juta dosis vaksin dalam bentuk bulk. Kemudian tahun 2021, Sinopharm mengusahakan 50 juta (dual dose), Cansino 20 juta (single dose), Sinovac 125 juta (dual dose).
Semua Dikontrol WHO
Kabar ini memantik perhatian dan suara kritis publik. Pemerintah dinilai terlampau buru-buru dalam mendatangkan vaksin. Seharusnya pertimbangan lebih matang dengan berbasiskan data ilmiah menjadi tolak ukur. Mengingat sampai saat ini belum ada satupun jenis vaksin yang dinyatakan siap digunakan.
Epidemiolog Universitas Indonesia, Pandu Riono, menegaskan semua vaksin corona masih dalam tahap uji klinis fase ke-3 dan belum ada yang selesai. Sehingga belum dapat diambil kesimpulan untuk menentukan vaksin mana yang lebih efektif dan aman bagi masyarakat. Pemerintah seharusnya dapat menunggu seluruh proses uji vaksin tuntas sehingga bisa memastikan pilihan jenis vaksin yang bakal didatangkan.
"Semuanya menunggu hasil evaluasi ilmiah. Makanya saya heran kenapa Komite Penanganan Covid sama PEN yang dipimpin Pak Airlangga (Menko Perekonomian Airlangga Hartarto) sudah melakukan nego-nego, ijon vaksin. Ya tidak boleh lah. Tunggu saja. Nanti kalau vaksinnya tidak efektif, buat apa? Buang-buang waktu," kata Pandu Riono kepada merdeka.com, Jumat pekan lalu.
Badan Pengawas Obat dan Makanan (BPOM) mencatat Indonesia telah mempunyai beberapa kandidat vaksin COVID-19 yang akan digunakan untuk program pemerintah. Semua vaksin tersebut mendapatkan Emergency Use Authorization (EUA) dari Badan POM.
Plt. Deputi I BPOM, Togi Hutadjulu, mengatakan bahwa lembaganya sebagai bagian dari Komite Penanganan Coronavirus Disease 2019 dan Pemulihan Ekonomi Nasional (KPC PEN), mengutamakan kehati-hatian terkait rencana vaksinasi COVID-19 kepada masyarakat luas. Semua akan mengacu kepada ketetapan yang berlaku di Indonesia. Termasuk tentang syarat keamanan, khasiat hingga mutu produk vaksin corona nanti.
"Jika telah dinyatakan memenuhi aspek keamanan, khasiat dan mutunya maka Badan POM dapat memberikan persetujuan apakah dalam bentuk Emergency Use Authorization (EUA) atau dalam bentuk Nomor Izin Edar (NIE)," ujar Togi kepada merdeka.com.
Togi menjelaskan, sistem registrasi khusus untuk kondisi darurat diberikan tanpa mengesampingkan aspek keamanan, khasiat dan mutu produk. Dalam proses evaluasi keamanan dan khasiat kandidat vaksin tersebut akan melibatkan Tim Komnas (Kominte Nasional) Penilai Obat yang terdiri dari para ahli farmakologi, klinisi dan para pakar.
Pengambilan keputusan pemberian izin penggunaan darurat ini harus dilakukan dengan pertimbangan kemanfaatan yang lebih tinggi dari risikonya. Keputusan diambil berdasarkan hasil evaluasi data keamanan dan khasiat vaksin.
Izin penggunaan darurat (EUA) telah ditetapkan dengan Peraturan Badan Pengawas Obat Dan Makanan Nomor 27 Tahun 2020 Tentang Perubahan Kedua Atas Peraturan Kepala Badan Pengawas Obat Dan Makanan Nomor 24 Tahun 2017 Tentang Kriteria Dan Tata Laksana Registrasi Obat. Sistem pemberian EUA yang diterapkan BPOM mengacu pada pedoman registrasi kondisi darurat World Health Organization (WHO), European Medicines Agency (EMA) dan United States Food and Drug Administration (US-FDA).
Berdasarkan ketentuan yang berlaku, Industri Farmasi (IF) yang memiliki EUA bertanggung jawab terhadap mutu vaksin. Pengawalan mutu vaksin oleh Badan POM antara lain dilakukan melalui inspeksi Cara Pembuatan Obat yang Baik (CPOB) atau Good Manufacturing Practices (GMP) ke fasilitas produksi vaksin, dan melakukan pengujian di laboratorium Pusat Pengembangan Pengujian Obat dan Makanan untuk proses pelulusan bets atau lot release.
Setiap bets produksi sebelum didistribusikan dan digunakan. Industri farmasi pemegang EUA wajib melakukan studi atau uji klinik lanjutan terhadap vaksin yang sedang dalam penelitian uji klinik untuk memastikan efektivitas dan keamanannya. "IF harus melakukan pemantauan farmakovigilans dan pelaporan efek samping vaksin serta melaporkan realisasi importasi, produksi, dan distribusi vaksin selama persetujuan penggunaan darurat." tegas dia.
BPOM bakal mengawasi rantai distribusi untuk memastikan mutu vaksin. Apalagi vaksin perlu penyimpanan khusus yang umumnya pada temperatur antara 2 sampai 8 derajat celcius. Sehingga manajemen rantai dingin merupakan hal yang krusial dilakukan untuk penjagaan mutu vaksin hingga sampai ke pengguna.
Setelah proses pemberian vaksin dilaksanakan, BPOM mengawasi aspek mutu dengan melakukan sampling vaksin dan pengujian mutunya serta pengawasan keamanan melalui program kegiatan farmakovigilans. Untuk itu, Badan POM memerlukan partisipasi dan kerja sama para sejawat tenaga kesehatan di lapangan.
Tenaga kesehatan diharapkan dapat memantau dan melaporkan kemungkinan kejadian ikutan pasca imunisasi atau KIPI yang dialami oleh masyarakat setelah menerima vaksin. Apabila terdapat peningkatan frekuensi efek samping maka BPOM dapat melakukan tindak lanjut dengan cara melakukan pengkajian dengan para ahli di bidangnya dan klinisi beserta Komite Nasional KIPI.
Terkait vaksin ditargetkan edar November ini, Kusnadi menegaskan bukan Sinovac yang sedang diuji Biofarma. Jika memang ada kebutuhan mendesak, pemerintah bisa saja membeli vaksin dari luar. Misalnya, mendatangkan Sinovac yang sudah selesai menjalankan uji klinis dari Uni Emirat Arab, Turki maupun Brazil. Karena negara tersebut memang menargetkan selesai uji klinis Sinovac segera selesai November
Lagi-lagi setelah uji klinis pun vaksin tidak bisa serta merta dibeli. Sebab negara yang bersangkutan harus memenuhi sejumlah syarat untuk menggunakan vaksin. Untuk penggunaan dalam negeri negara bersangkutan harus mendapatkan izin BPOM di negara tersebut. Sementara untuk penggunaan di luar negeri, vaksin harus mendapatkan izin dari WHO.
"Memang kesepakatan global begitu. Supaya vaksin ini mutunya terjamin. Jadi enggak bisa semua negara bisa seenaknya begitu. Dikontrol sama WHO," ujar Kusnandi.
Ketika disinggung soal produksi Sinovac setelah selesai uji klinis nanti, Kusnadi enggan berkomentar. Dia hanya menekankan bahwa ketersediaan bahan baku vaksin berperan penting pada kemampuan produksi ke depan. Saat ini negara yang satu dengan yang berlomba-lomba untuk mendapatkan bahan baku vaksin.
Negara yang kekurangan pasokan bahan baku tentu akan mendapatkan hambatan untuk berproduksi. Karena itulah, salah satu jalan yang bisa ditempuh untuk memenuhi kebutuhan vaksin, yakni dengan membelinya dari luar negeri. Dalam catatannya, Amerika membeli 500 juta dosis. Sedangkan Inggris hanya membeli bahannya.
Menurut Kusnadi, Biofarma hanya kebagian 140 juta dosis. Kini yang baru tersedia 40 juta dosis. Kondisi ini membuat dia pesimis bahwa vaksin corona Sinovac bakal sesuai target. "Jadi kalau kita ingin dapat vaksin cepat-cepat kita harus beli dari luar. Karena bahannya sangat susah dapatnya," Kusnadi mengungkapkan.
Presiden Joko Widodo, secara tegas dia menyatakan bahwa pengadaan dan pelaksanaan vaksinasi harus memperhatikan keamanan dan keefektifan pada masyarakat. Sebab menurut dia, jika ada satu kesalahan hal tersebut akan menimbulkan ketidakpercayaan pada masyarakat. Menurut dia, aspek keamanan vaksin, merupakan fokus utama untuk masyarakat termasuk para pakar dan peneliti.
Mantan Gubernur DKI Jakarta tersebut juga meminta agar jangan terburu-buru untuk melakukan vaksinasi. Sebab itu dia meminta semua tahapan harus melalui kaidah-kaidah saintifik hingga standar kesehatan. Jangan sampai timbul persepsi bahwa pemerintah mengambil langkah tergesa-gesa. "Jangan timbul persepsi pemerintah tergesa-gesa, terburu-buru tanpa ikuti koridor-koridor ilmiah yang ada. tolong betul-betul kita lalui semuanya meskipun ingin dipercepat, hal-hal tadi jangan sampai dilupakan," ungkapnya.
Ketua Komite Penanganan Covid-19 dan Pemulihan Ekonomi Nasional (KPCPEN) Airlangga Hartarto menegaskan, pengiriman kandidat vaksin dan pelaksanaan vaksinasi tergantung dari hasil uji klinis yang dilakukan masing-masing produsen vaksin. Tetapi, pelaksanaan vaksinasinya setelah mendapat perizinan dari Badan Pengawas Obat dan Makanan (BPOM).
Menurutnya, BPOM akan memastikan keselamatan dan efektivitas kandidat vaksin tersebut untuk digunakan di Indonesia. Tentunya dengan mengacu pada kaidah ilmiah keilmuan dan etis, sesuai pedoman WHO. "Keselamatan jiwa manusia adalah hukum tertinggi. Itu yang kita utamakan," dalam keterangannya pada Jumat, 22 Oktober 2020.
Menko Perekonomian ini merinci, sejauh ini telah terjalin kerja sama dengan empat produsen vaksin, yaitu Sinovac, Sinopharm/G42, Cansino, dan Astra Zeneca. Selain jalur kerja sama internasional, Pemerintah juga mengembangkan melalui jalur mandiri yaitu Vaksin Merah Putih.
Adapun jumlah total kandidat vaksin yang sangat berpotensi untuk dapat disediakan di Indonesia adalah sekitar 300 juta dosis yang diperuntukkan bagi sekitar 160-185 juta orang. Angka ini masih sangat dinamis karena masih dalam tahap finalisasi dan sangat tergantung dari ketersediaan vaksinnya.
Dia menjelaskan, pemerintah telah mengeluarkan Peraturan Presiden terkait Pengadaan Vaksin dan Pelaksanaan Vaksinasi dalam rangka Penanggulangan Pandemi Covid-19 dan dielaborasi lebih lanjut dalam Peraturan Menteri Kesehatan (Permenkes). "Metode pengadaannya perlu dibuatkan regulasi agar tepat sasaran, waktu dan jumlah," Airlangga menjelaskan.
Ketua Satgas Covid-19 Ikatan Dokter Indonesia (IDI), Zubairi Djoerban menegaskan, agar vaksin bisa dipakai masyarakat perlu pembuktian kepastian keamanan dan tingkat efektifitasnya sesuai berbagai kaidah kesehatan. Memang sejauh ini ada sejumlah negara yang sudah menggunakan vaksin meskipun masih dalam tahap uji klinis fase III.
"Kalau kita mau ikuti Emergency Use Authorization (EUA) itu pun harus perlu konsultasi dengan badan ilmiah namanya ITAGI selain IDI atau juga BPOM yang mengeluarkan izinnya," ungkap dia kepada merdeka.com.
Sementara itu, Pandu mengingatkan pemerintah untuk menghargai independensi BPOM dalam pengadaan dan pelaksanaan vaksinasi. Sehingga tidak ada paksaan kepada BPOM untuk mengeluarkan EUA. Bila dilakukan tentu langkah tersebut tidak bijak di tengah belum adanya kepastian soal vaksin mana yang paling ampuh.
Vaksin corona wajib hukumnya untuk dipastikan aman dan efektif. Evaluasi ilmiah diharapkan menjadi perhatian utama dalam proses pengadaan dan pelaksanaan vaksinasi. "Jadi pemerintah itu harus sabar. Jangan mendorong Badan POM yang begitu tegas dan tegar dibuat bingung. Karena ada permintaan tadi," kata Pandu menegaskan.
(mdk/ang)Cobain For You Page (FYP) Yang kamu suka ada di sini,
lihat isinya
Maxi berujar, kelompok pertama yang bisa mendapatkan vaksin gratis adalah yang belum pernah menerima vaksin Covid-19 sama sekali.
Baca Selengkapnya
Mulai 1 Januari 2024, vaksinasi Covid-19 bagi masyarakat umum berbayar.
Baca Selengkapnya
IDI mengimbau Kemenkes tidak terburu-buru mengesahkan RPP Kesehatan
Baca Selengkapnya
Namun kalau untuk yang komorbid, kata Menkes, risiko tetap ada karena virusnya tidak hilang.
Baca Selengkapnya
Beredar klaim penerima vaksin Covid-19 mRNA akan meninggal dalam 3 atau 5 tahun
Baca Selengkapnya
Penularan varian JN.1 telah ditemukan di Jakarta dan Batam.
Baca Selengkapnya
Sebelumnya, Budi menyatakan vaksin cacar monyet masih menyasar kelompok tertentu, seperti penderita HIV.
Baca Selengkapnya
Mulai Januari 2024, vaksinasi Covid-19 tidak lagi gratis alias berbayar.
Baca Selengkapnya