Mengenal Emergency Use Authorization dari BPOM untuk Vaksin Covid-19
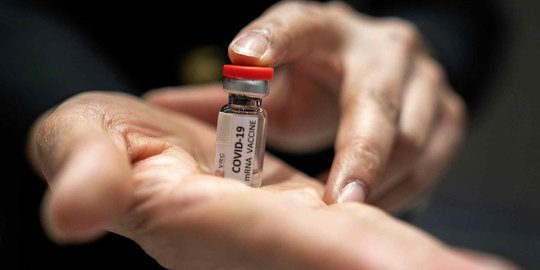
Merdeka.com - Emergency Use Authorization atau EUA belakangan ini sering kali disebut dalam pembahasan terkait vaksin Covid-19. Direktur Registrasi Obat BPOM, Lucia Rizka Andalusia melalui siaran langsung Youtube Lawan Covid19 ID pada Rabu (21/10) menjelaskan terkait apa itu EUA dan syarat-syarat yang harus dipenuhi untuk mendapatkannya.
"EUA adalah persetujuan penggunaan obat atau vaksin yang belum mendapatkan izin edar atau belum disetujui untuk indikasi penggunaan tersebut dalam kondisi darurat atau emergency," kata Lucia saat berdiskusi di siaran langsung Youtube Lawan Covid19 ID, Rabu (21/10).
Meski sudah dapat digunakan, Lucia menegaskan bahwa EUA sendiri bukan merupakan izin edar.
-
Mengapa data penelitian sangat penting? Data merupakan informasi yang diperoleh untuk menjawab pertanyaan penelitian atau tujuan penelitian yang telah ditetapkan. Data ini diperoleh melalui berbagai macam sumber dan metode yang digunakan dalam penelitian.
-
Mengapa data sekunder penting dalam penelitian? Data sekunder dapat berupa data statistik yang sangat bermanfaat dalam penelitian.
-
Apa itu data statistik? Data statistik sangat diperlukan dalam sebuah survey atau perhitungan. Namun apa itu data statistik? Simak jenis data statistik dan contohnya berikut ini.
-
Kenapa penting data pemilih akurat? Dengan memutakhirkan data pemilih, Pantarlih membantu mencegah berbagai masalah yang dapat timbul, seperti pemilih ganda, pemilih fiktif, atau pemilih yang tidak memenuhi syarat.
-
Apa saja jenis data dalam penelitian? Jenis data secara umum dibagi menjadi dua, yaitu data kuantitatif dan data kualitatif.
-
Kenapa fakta penting? Fakta sangat penting dalam komunikasi sehari-hari dan dalam menyajikan informasi yang dapat dipercaya, terutama dalam konteks berita atau laporan ilmiah.
"EUA ini bukan izin edar. Nantinya akan bisa menjadi izin edar manakala dia sudah memenuhi persyaratan yang full sebagai izin edar. Dia (EUA) dapat digunakan dan didistribusikan secara terbatas."
BPOM juga sudah menentukan standar dan kriteria untuk obat atau vaksin yang dapat diberikan EUA. Standar dan kriteria tersebut dibuat berdasarkan referensi dan standar-standar internasional, khususnya dari WHO yang sudah memiliki standar pemberian persetujuan dalam kondisi emergency atau Emergency Use Listing (EUL).
Untuk mendapatkan EUA, suatu obat atau vaksin harus terlebih dahulu mengikuti beberapa persyaratan dan evaluasi dari BPOM. Beberapa persyaratannya adalah harus melaksanakan uji klinik terhadap vaksin tersebut dan adanya pemantauan farmakovigilans yang ketat atau pemantauan post persetujuan, serta pemantauan efek samping.
Selain itu data-data dari vaksin atau obat juga diperlukan untuk pertimbangan pemberian EUA.
"Untuk mendapatkan EUA tersebut, maka yang utama adalah data mutu dari vaksin tersebut. Bagaimana bahan bakunya sampai kemudian menjadi produk jadi. Itu dibuat dengan standar GMP atau standar cara pembuatan obat yang baik."
Data klinis yang diperoleh dari hasil uji klinik vaksin juga digunakan sebagai dasar pemberian EUA untuk vaksin tersebut. Hal lain yang menjadi pertimbangan dalam pemberian EUA adalah risk dan benefitnya.
"Pengambilan keputusan yang dilakukan oleh Badan POM dalam pemberian EUA itu dengan pertimbangan risk benefit, ya. Tentunya harus lebih berat kemanfaatannya, harus lebih besar kemanfaatannya dibandingkan dengan risiko."
Untuk menilai apakah vaksin tersebut nantinya layak diberikan EUA, Badan POM akan bekerja sama dengan tim komnas penilai obat dan expert yang ahli di bidang vaksin.
Berikut poin-poin dari syarat pemberian EUA:
-Telah ada penetapan kondisi darurat kesehatan oleh pemerintah
-Telah memiliki bukti ilmiah aspek keamanan dan khasiat yang cukup dari obat/vaksin yang tentunya berdasarkan data non klinis dan data klinis yang ada
-Memiliki data mutu yang memenuhi standar yang berlaku dan diproduksi di sarana yang memenuhi CPOB
-Memiliki kemanfaatan yang lebih besar dari risiko berdasarkan kajian data klinis dan data non klinis
-Belum ada alternatif pengobatan atau penatalaksanaan yang memadai dan disetujui untuk pengobatan penyakit pada kondisi kedaruratan kesehatan masyarakat.
Reporter Magang: Maria Brigitta Jennifer
(mdk/rhm)Cobain For You Page (FYP) Yang kamu suka ada di sini,
lihat isinya

Namun kalau untuk yang komorbid, kata Menkes, risiko tetap ada karena virusnya tidak hilang.
Baca Selengkapnya
Produksi vaksin dalam negeri dianggap akan mampu mendorong ketahanan kesehatan nasional.
Baca Selengkapnya
Mulai 1 Januari 2024, vaksinasi Covid-19 bagi masyarakat umum berbayar.
Baca Selengkapnya
Pemerintah berupaya mencegah penyebaran Mpox dengan melakukan vaksinasi yang sudah disetujui WHO dan BPOM.
Baca Selengkapnya
Hal tersebut sesuai dengan arahan Badan Pengawas Obat dan Makanan (BPOM) yang mengunjungi fasilitas produksi PT Etana Biotechnologies Indonesia.
Baca Selengkapnya
Pemanfaatan BMN ini digunakan untuk usaha yang lebih produktif.
Baca Selengkapnya
Pentingnya indikator untuk menentukan apakah negara sudah masuk dalam kondisi darurat.
Baca Selengkapnya
Vaksin booster masih gratis dan dapat ditemukan di puskesmas atau faskes terdekat.
Baca Selengkapnya
Sepanjang 2023, Etana berhasil kembangkan produk bioteknologi dan vaksin.
Baca Selengkapnya