Sistem Periodik Unsur Kimia, Kenali Sifat-Sifat dan Penomoran di Dalamnya
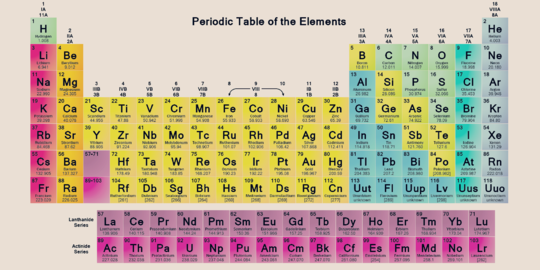
Merdeka.com - Sistem periodik unsur kimia adalah hal yang wajib diketahui oleh para pelajar yang mengambil jurusan IPA di sekolah. Sistem periodik unsur kimia juga wajib dipahami oleh Anda yang pekerjaannya terlibat dengan unsur-unsur ini. Sistem periodik unsur kimia disebut tabel periodik, dan fungsinya adalah untuk mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur.
Sistem periodik unsur kimia adalah susunan unsur-unsur berdasarkan nomor atom dan kemiripan sifat-sifatnya. Anda perlu untuk mengenali, memahami, dan menghafalnya guna menghitung reaksi kimia. Dengan tabel periodik, Anda bisa mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur.
Unsur-unsur dalam sistem periodik unsur kimia terdiri dari dua kelompok, yakni golongan (lajur vertical), dan periode (lajur horizontal). Meski nampak rumit, Anda akan terbiasa dan mudah menghafalnya jika sering berlatih. Mengutip Liputan6.com, berikut hal-hal yang perlu diketahui tentang sistem periodik unsur kimia.
-
Bagaimana tabel periodik membantu memahami unsur? Dengan tabel periodik, Anda bisa mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur.
-
Mengapa unsur diurutkan secara periodik? Perkembangan sistem unsur periodik kima mengikuti hukum periodik bahwa bila unsur-unsur disusun berdasarkan kenaikan nomor atom, maka sifat unsur akan berulang secara periodik.
-
Dimana golongan unsur dalam tabel periodik? Golongan unsur periodik ditempatkan pada lajur vertikal dalam tabel periodik unsur modern.
-
Apa yang diurutkan dalam tabel periodik? Sistem periodik unsur kimia adalah susunan unsur-unsur berdasarkan nomor atom dan kemiripan sifat-sifatnya.
-
Dimana simbol bahan kimia digunakan? Simbol-simbol ini umumnya digunakan dalam label bahan kimia dan tanda peringatan untuk memberi tahu pengguna tentang terkait risiko penggunaan atau paparan bahan kimia tersebut.
-
Kenapa simbol bahan kimia penting? Simbol bahan kimia memiliki peranan penting dalam ilmu kimia. Simbol ini digunakan untuk memudahkan komunikasi, merepresentasikan unsur kimia, hingga mendukung keselamatan.
Kelompok Unsur dalam Sistem Periodik Kimia
Sistem periodik unsur kimia yang disusun oleh Moseley berkembang dengan baik hingga sampai pada bentuk yang sekarang ini. Perkembangan sistem periodik unsur kimia mengikuti hukum periodik bahwa bila unsur-unsur disusun berdasarkan kenaikan nomor atom, maka sifat unsur akan berulang secara periodik. Telah disebutkan di atas bahwa sistem periodik unsur kimia terdiri dari dua kelompok yakni golongan dan periode. Berikut pembagiannya:
1. Golongan
Golongan ditempatkan pada lajur vertikal dalam tabel periodik unsur modern. Penentuan golongan berkaitan dengan sifat-sifat yang dimiliki unsur tersebut. Unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip. Beberapa golongan diberi nama khusus, yakni:
- Golongan IA, disebut golongan alkali (kecuali H), terdiri dari H, Li, Na, K, Rb, Cs, Fr;
- Golongan IIA, disebut golongan alkali tanah, terdiri dari Be, Mg, Ca, Sr, Ba, Ra;
- Golongan VIIA, disebut golongan halogen, terdiri dari F, Cl, Br, I, At;
- Golongan VIIIA, disebut golongan gas mulia, terdiri dari He, Ne, Ar, Kr, Xe, Rn;
- Golongan IIIA, disebut golongan boron-aluminium, terdiri dari B, Al, Ga, In, Ti;
- Golongan IVA, disebut golongan karbon-silikon, terdiri dari C, Si, Ge, Sn, Pb;
- Golongan VA, disebut golongan nitrogen-fosforus, terdiri dari N, P, As, Sb, Bi;
- Golongan VIA, disebut golongan oksigen-belerang, terdiri dari O, S, Se, Te, Po;
- Golongan IB sampai dengan VIIIB disebut golongan transisi
2. Periode
Periode ditempatkan pada lajur horizontal dalam tabel periodik unsur kimia. Periode suatu unsur menunjukkan nomor kulit yang sudah terisi elektron (n terbesar) berdasarkan konfigurasi elektron. Dalam sistem periodik unsur terdapat 7 periode, yaitu:
- Periode ke-1, terdiri atas 2 unsur
- Periode ke-2, terdiri atas 8 unsur
- Periode ke-3, terdiri atas 8 unsur
- Periode ke-4, terdiri atas 18 unsur
- Periode ke-5, terdiri atas 18 unsur
- Periode ke-6, terdiri atas 32 unsur, 18 unsur seperti period eke-4 dan ke-5, 14 unsur deret lantanida
- Periode ke-7, merupakan periode unsur yang belum lengkap. Terdapat deret aktinida.
Klasifikasi Sistem Periodik Unsur Kimia
Pada tahun 1984, J.A.R Newlands mengklasifikan sistem periodik unsur kimia berdasarkan kenaikan berat atomnya. Unsur ini dapat dikenali dengan nomor urut dan dibagi dalam tujuh golongan. Tujuh golongan tersebut adalah Hidrogen, Litium, Berilium, Karbon, Nitrogen, Boron serta Oksigen. Hubungan ketujuh golongan ini dikenal sebagai hukum oktaf.
Pada sistem periodik unsur kimia, golongan merupakan kolom vertikal yang terdapat pada tabel periodik. Golongan sangat penting untuk metode pengklasifikasian unsur-unsur. Golongan berisi unsur-unsur yang memiliki susunan elektron terluar yang sama. Karena memiliki elektron yang sama, maka unsur-unsur tersebut memiliki sifat kimia yang sama.
Unsur-unsur pada golongan pertama merupakan logam alkali atau golongan utama. Sedangkan golongan kedua dinamakan logam transisi, yang merupakan logam alkali tanah. Dan dua deret dari bagian bawah merupakan logam transisi dalam yang terdiri atas lanthanide dan aktinida.
Sementara itu, periode adalah barisan horizontal yang terdapat pada tabel periodik. Terdapat 7 periode dalam tabel periodik, di mana masing-masing tabel mewakili tingkat energi atom yang dimiliki. Tidak semua periode memiliki jumlah unsur yang sama. Di mana jumlah unsur terkecil terdapat pada periode 1 yang berjumlah 2 unsur. Sedangkan jumlah unsur tebanyak adalah pada periode 6 yang memiliki 32 unsur.
Sifat Sistem Periodik Unsur Kimia
Berikut sifat-sifat yang terkandung dalam sistem periodik unsur kimia:
Berdasarkan sifat unsur-unsur, sistem periodik unsur kimia terbagi dalam 3 jenis yaitu logam, non logam dan juga metalloid. Logam memiliki sifat yang cenderung melepaskan elektron dari non logam untuk membentuk ion positif. Sedangkan non logam cenderung menerima elektron dari logam. Laiin halnya dengan unsur metalloid, yang memiliki kedua sifat seperti logam dan non logam.
Jari-jari atom adalah jarak dari inti atom ke orbital elektron terluar yang stabil dalam suatu atom dalam keadaan setimbang. Jarak tersebut dapat diukur dalam satuan pikometer atau angstrom. Dalam satu golongan dari atas ke bawah, jari-jari atom cenderung untuk membesar setara dengan pertambahan dapa kulit elektron.
Kereaktifan sebuah unsur pada tabel periodik dalam satu periode dari kiri ke kanan bertambah hingga golongan VIIA.
Energi ionisasi pertama adalah energi yang diserap untuk melepas satu elektron dari sebuah atom. Sedangkan energi ionisasi atom kedua adalah energi yang diserap untuk melepas elektron kedua dari sebuah atom, dan seterusnya.
Afinitas eletron adalah jumlah energi yang dilepaskan ketika sebuah elektron ditambahkan ke dalam kolom atom netral untuk membentuk ion negatif. Sifat non logam memiliki nilai lebih tinggi pada afinitas elektron daripada sifat logam. Afinitas elektron secara umum terus meningkat sepanjang periode.
Kelektronegatifan merupakan kemampuan atau kecenderungan suatu atom untuk menangkap ataupun menarik kembali elektron dari atom lainnya.
Sistem Periodik Unsur Kimia oleh Para Tokoh
Dalam sejarah perkembangannya, sistem periodik unsur kimia yang digunakan saat ini adalah sistem periodik unsur kimia modern yang dipublikasikan oleh Dimitri Mendeleev pada tahun 1869. Namun menurut sejarahnya, Robert Boyle adalah orang pertama yang memberikan definisi mengenai unsur. Menurut Boyle, unsur merupakan zat yang tidak dapat dibagi menjadi dua zat atau lebih secara kimiawi.
Setelah Boyle memberikan penjelasan mengenai hal tersebut, pada tahun 1769 Lavoiser pun menerbitkan daftar unsur-unsur dan membaginya pada unsur logam maupun unsur non logam. Menurut Lavoiser, terdapat perbedaan antara logam dan non logam yakni;
- Logam berwujud padat pada suhu kamar kecuali raksa, mengkilap saat di gosok-gosokan, merupakan konduktor yang baik, dapat ditempa atau direnggangkan dan adalah penghantar panas yang baik. Sementara itu,
- Non logam ada yang berupa zat padat, cair atau gas pada suhu kamar, tidak mengkilap jika digosok, kecuali intan atau karbon, bukan konduktor yang baik, umumnya rapuh terutama berwujud padat dan bukan penghantar panas yang baik.
Dobereiner adalah orang pertama yang menemukan hubungan sifat dengan massa atom. Unsur-unsur tersebut dikelompokkan menjadi 3 triade, yaitu;
- Triade Litium (Li), Natrium (Na), Kalium (K)
- Triade Kalsium (Ca), Stronsium (Sr), Barium (Br)
- Triade klor (Cl), Brom (Br), Iodium (I)
Tahun 1869, Dmitri Ivanovich Mendeleev melakukan pengamatan 63 unsur yang telah dikenal dan mendapatkan hasil bahwa sifat dari massa atom itu relatif. Berdasarkan hasil pengamatannya tersebut, unsur-unsur ditempatkan pada golongan dan juga periode yang dikenal hingga saat ini.
Nama-nama Unsur Kimia dan Simbolnya
1. Hidrogen: H
2. Helium: He
3. Lithium: Li
4. Beryllium: Be
5. Boron: B
6. Carbon: C
7. Nitrogen: N
8. Oxygen: O
9. Fluorine: F
10. Neon: Ne
11. Sodium: Na
12. Magnesium: Mg
13. Aluminum: Al
14. Silicon: Si
15. Phosphorus: P
16. Sulfur: S
17. Chlorine: Cl
18. Argon: Ar
19. Potassium: K
20. Calcium: Ca
21. Scandium: Sc
22. Titanium: Ti
23. Vanadium: V
24. Chromium: Cr
25. Manganese: Mn
26. Iron: Fe
27. Cobalt: Co
28. Nickel: Ni
29. Copper: Cu
30. Zinc: Zn
31. Gallium: Ga
32. Germanium: Ge
33. Arsenic: As
34. Selenium: Se
35. Bromine: Br
36. Krypton: Kr
37. Rubidium: Rb
38. Strontium: Sr
39. Yttrium: Y
40. Zirconium: Zr
41. Niobium: Nb
42. Molybdenum: Mo
43. Technetium: Tc
44. Ruthenium: Ru
45. Rhodium: Rh
46. Palladium: Pd
47. Silver: Ag
48. Cadmium: Cd
49. Indium: In
50. Tin: Sn
51. Antimony: Sb
52. Tellurium: Te
53. Iodine: I
54. Xenon: Xe
55. Cesium: Cs
56. Barium: Ba
57. Lanthanum: La
58. Cerium: Ce
59. Praseodymium: Pr
60. Neodymium: Nd
61. Promethium: Pm
62. Samarium: Sm
63. Europium: Eu
64. Gadolinium: Gd
65. Terbium: Tb
66. Dysprosium: Dy
67. Holmium: Ho
68. Erbium: Er
69. Thulium: Tm
70. Ytterbium: Yb
71. Lutetium: Lu
72. Hafnium: Hf
73. Tantalum: Ta
74. Tungsten: W
75. Rhenium: Re
76. Osmium: Os
77. Iridium: Ir
78. Platinum: Pt
79. Gold: Au
80. Mercury: Hg
81. Thallium: Tl
82. Lead: Pb
83. Bismuth: Bi
84. Polonium: Po
85. Astatine: At
86. Radon: Rn
87. Francium: Fr
88. Radium: Ra
89. Actinium: Ac
90. Thorium: Th
91. Protactinium: Pa
92. Uranium: U
93. Neptunium: Np
94. Plutonium: Pu
95. Americium: Am
96. Curium: Cm
97. Berkelium: Bk
98. Californium: Cf
99. Einsteinium: Es
100. Fermium: Fm
111. Mendelevium: Md
112. Nobelium: No
113. Lawrencium: Lr
114. Rutherfordium: Rf
115. Dubnium: Db
116. Seaborgium: Sg
117. Bohrium: Bh
118. Hassium: Hs
119. Meitnerium: Mt
120. Darmstadtium: Ds
121. Roentgenium: Rg
122. Copernicium: Cn
123. Ununtrium: Uut
124. Ununquadium: Uuq
125. Ununpentium: Uup
126. Ununhexium: Uuh
127. Ununseptium: Uus
128. Ununoctium: Uuo (mdk/edl)
Cobain For You Page (FYP) Yang kamu suka ada di sini,
lihat isinya

Sistem periodik unsur kimia adalah hal yang wajib diketahui oleh para pelajar yang mengambil jurusan IPA di sekolah.
Baca Selengkapnya
Simbol bahan kimia memiliki peran penting dalam sistem kerja dan keselamatan.
Baca Selengkapnya
Kata sifat memiliki peran krusial dalam menyampaikan nuansa, karakteristik, dan deskripsi suatu objek atau konsep.
Baca Selengkapnya
Kunci gitar dasar wajib dipelajari saat Anda hendak memainkan alat musik satu ini.
Baca Selengkapnya
Merdeka.com merangkum informasi tentang 9 unsur musik dan penjelasan lengkapnya yang perlu Anda ketahui.
Baca Selengkapnya
Berikut kumpulan contoh peribahasa Indonesia beserta artinya.
Baca Selengkapnya
Kata sifat umumnya berfungsi sebagai predikat, objek dan penjelas subjek.
Baca Selengkapnya