Sistem Periodik Unsur Beserta 6 Sifatnya, Para Kimiawan Wajib Tahu
Sistem periodik unsur merupakan susunan unsur-unsur kimia berdasarkan urutan nomor atom dan kemiripan sifat unsur-unsur tersebut.
Sistem periodik unsur dilansir dari studiobelajar.com merupakan susunan unsur-unsur kimia berdasarkan urutan nomor atom dan kemiripan sifat unsur-unsur tersebut. Partikel terkecil dari sebuah unsur adalah atom.
Atom terdiri atas proton dan neutron sebagai inti atom dan elektron yang mengelilingi inti atom. Berikut gambar sistem periodik unsur beserta tabel penjelasannya.
-
Apa yang istimewa dari Yogyakarta? Pada zaman pendudukan Jepang, wilayah Daerah Istimewa Yogyakarta disebut dengan istilah Yogyakarta Kooti.
-
Apa yang dilakukan Kama saat liburan di Yogyakarta? Anak-anak Zaskia Adya Mecca menemukan kebahagiaan dalam hal-hal sederhana seperti jajan gulali dan duduk santai di pinggir jalan.
-
Siapa yang kuliah di Jogja? Perempuan yang tidak diketahui namanya itu kerap berdoa agar diberi kekuatan untuk selalu mencari nafkah demi keluarga. Terutama anaknya yang sedang menempuh pendidikan tinggi di Yogyakarta.“Anak saya juga kuliah di situ, di Jogja. Sekarang semester akhir, makanya saya ada di sini itu karena ya butuh biaya,” ucap perempuan tersebut.
-
Apa bisnis yang dirintis oleh Risma di Yogyakarta? Risma memulai usaha kecil-kecilan dari pre-order di rumah. Dari sinilah Risma mulai mengumpulkan modal sedikit demi sedikit hingga akhirnya memberanikan diri untuk membuka bisnis ramen.
-
Apa peran Yakob Sayuri di Timnas Indonesia? Pemain Kunci Ketidakhadiran Yakob Sayuri dan Yance Sayuri di Timnas Indonesia tentunya sangat disayangkan. Keduanya memiliki potensi untuk memberikan kontribusi besar bagi tim yang dilatih oleh Shin Tae-yong. Terutama, Yakob Sayuri memiliki peran yang sangat signifikan.
-
Apakah Yoni Gambar di Jombang melambangkan apa? Konsep Hindu mengenal yoni sebagai lambang Parwati/Dewi Uma, pasangan Dewa Siwa. Adapun, Dewa Siwa dilambangkan dengan lingga.
Tabel periodik unsur
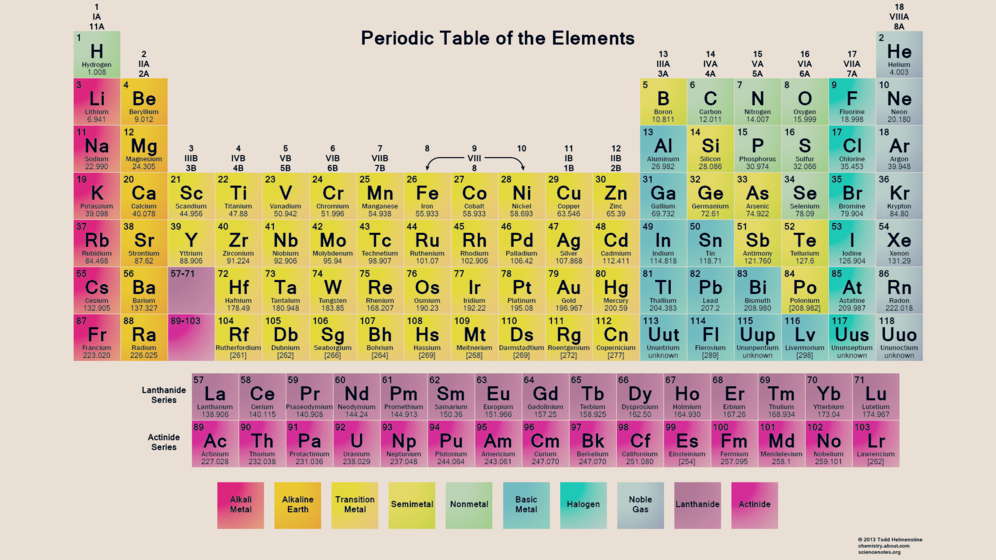 sciencenotes.org
sciencenotes.org
Penjelasan tabel periodik
| No | Nama | Simbol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Sumber: gurupendidikan.co.id
Sifat periodik unsur
Sampai saat ini terdapat kurang lebih 118 unsur yang ada di dunia. Unsur yang ditambahkan pada table periodik unsur adalah ununtrium (Uut atau elemen 13), ununpentium (Uup atau elemen 115), ununseptium (Uus atau elemen 117), dan ununoctium (Uuo atau elemen 118).
Penambahan unsur ini telah diverifikasi pada tanggal 30 Desember 2015 oleh tim gabungan dari International Union of Pure and Applied Chemistry (IUPAC) dan International Union of Pure and Applied Physics (IUAPAP).
Melansir dari gurupendidikan.co.id sifat periodik unsur merupakan sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom (dari kiri ke kanan pada satu periode atau dari atas ke bawah dalam satu golongan).
1. Jari-jari atom
Jari-jari atom merupakan jarak antara inti hingga kulit terluar elektron. Jari-jari ini dipengaruhi oleh muatan inti dan jumlah kulit.
Pada unsur segolongan, semakin banyak kulit maka jari-jari semakin besar. Sedangkan unsur seperiode, semakin besar muatan inti semakin kecil jari-jari.hal ini disebabkan karena daya tarik inti lebih kuat.
2. Sifat logam dan nonlogam
Sifat logam dalam tabel periodik semakin ke bawah semakin bertambah, semakin ke kanan semakin berkurang. Batas unsur logam berada pada sebelah kiri, sedangkan batas unsur nonlogam berada di sebelah kanan pada tabel periodik unsur.
3. Kereaktifan
Kereaktifan sebuah unsur pada tabel periodik unsur dari kiri ke kanan dalam satu periode bertambah hingga golongan VIIA.
4. Keelektronegatifan
Semakin besar energi ionisasi dan afinitas elektron pada tabel periodik berbanding lurus dengan semakin besarnya keelektronegatifan unsur.
5. Energi ionisasi
Energi ionisasi merupakan energi yang diperlukan untuk melepaskan elektron yang terikat paling lemah oleh suatu atom. Dalam satu golongan, dari atas ke bawah, energi ionisasi akan semakin kecil. Berbeda jika dilihat dalam satu priode, dari kiri ke kanan, energi ionisasi akan semakin kuat.
6. Afinitas Elektron
Afinitas elektron adalah besar energi yang dihasilkan atau dilepaskan suatu atom untuk menarik sebuah elektron. Dalam satu golongan dari atas ke bawah, afinitas elektron berkurang. Hal ini sama jika dalam satu periode dari kanan ke kiri.