Asam Sulfat Adalah Zat yang Bersifat Korosif, Ketahui Sifat dan Manfaatnya dalam Kehidupan Sehari-hari
Asam sulfat (H2SO4) adalah asam kuat yang berwarna bening, tidak berbau, dan sangat korosif.

Asam sulfat (H2SO4) adalah asam kuat yang berwarna bening, tidak berbau, dan sangat korosif.

Asam Sulfat Adalah Zat yang Bersifat Korosif, Berikut Penjelasannya
Asam sulfat (H2SO4) adalah asam kuat yang berwarna bening, tidak berbau, dan sangat korosif.
Sifat-sifatnya meliputi sifat korosif yang dapat menyebabkan kerusakan pada kulit, logam, dan bahan organik. Asam sulfat sering digunakan dalam industri sebagai bahan baku untuk pembuatan pupuk, bahan kimia, dan baterai.
Manfaatnya antara lain sebagai larutan elektrolit dalam baterai, pelarut dalam pembuatan senyawa kimia, dan sebagai pengawet makanan.
Pertolongan pertama jika terpapar asam sulfat adalah dengan segera menghilangkan pakaian yang terkena asam sulfat, lalu membersihkan area yang terkena dengan banyak air selama minimal 15 menit. Penting untuk segera mendapatkan bantuan medis jika terjadi kontak dengan asam sulfat.
Bahaya terpapar asam sulfat mencakup kerusakan kulit, iritasi pada saluran pernafasan jika terhirup, dan kerusakan mata jika terkena. Penggunaan asam sulfat dalam industri harus dilakukan dengan hati-hati dan mematuhi prosedur keselamatan kerja yang ketat untuk mencegah terpapar dan mengurangi risiko kecelakaan.
Berikut penjelasan mengenai asam sulfat dan sifatnya:

Apa Itu Asam Sulfat?
Asam sulfat adalah zat kimia yang memiliki karakteristik berupa cairan berwarna bening, tidak berbau, dan sangat korosif.
Sifatnya yang korosif membuatnya memiliki kemampuan untuk menguraikan berbagai bahan organik dan anorganik. Asam sulfat memiliki berbagai penggunaan, terutama dalam industri.
Salah satu penggunaan utamanya adalah sebagai bahan baku dalam produksi pupuk fosfat.
Selain itu, asam sulfat juga digunakan dalam produksi deterjen, pewarna tekstil, dan kertas.
Di sektor industri kimia, asam sulfat digunakan dalam proses pengolahan logam, pembuatan asam klorida, dan pembuatan bahan bakar. Penggunaan asam sulfat juga dapat ditemui dalam industri petrokimia, farmasi, dan pemurnian minyak.
Dengan berbagai sifat dan karakteristiknya, asam sulfat menjadi komponen penting dalam industri karena kontribusinya yang vital dalam proses produksi berbagai produk.
Meski begitu, penggunaan asam sulfat juga harus diatur dengan ketat karena sifatnya yang korosif dan berbahaya bagi lingkungan serta kesehatan manusia.

Rumus Kimia Asam Sulfat
Asam sulfat, dengan rumus kimia H2SO4, adalah senyawa kimia penting yang digunakan dalam industri kimia dan proses manufaktur lainnya. Proses pembuatan asam sulfat melibatkan beberapa tahapan. Tahap pertama melibatkan oksidasi belerang (S) menjadi dioksida belerang (SO2) dengan udara.
Kemudian, belerang trioksida (SO3) dihasilkan melalui reaksi SO2 dengan oksigen di hadapan katalis vanadium pentoksida.
Tahap terakhir adalah penyerapan belerang trioksida dalam larutan asam sulfat pekat, yang menghasilkan asam sulfat dengan kekuatan tertentu. Rumus kimia asam sulfat yang terbentuk dalam proses ini adalah H2SO4.
Selain itu, asam sulfat juga dapat diperoleh melalui reaksi belerang trioksida dengan asam sulfat pekat. Rumus kimia reaksi tersebut adalah:
SO3 + H2SO4 → H2S2O7
H2S2O7 + H2O → 2H2SO4
Dengan demikian, asam sulfat dapat dihasilkan melalui beberapa metode pembuatan, dan memiliki berbagai aplikasi dalam industri, termasuk dalam produksi pupuk, deterjen, baterai, dan pengolahan logam.
Keseluruhan, proses pembuatan asam sulfat melalui tahapannya dan rumus kimianya memainkan peran penting dalam industri kimia modern.
Sifat Asam Sulfat
Asam sulfat, dengan rumus kimia H2SO4, memiliki sifat yang sangat korosif dan berbahaya.
Asam sulfat dikenal sebagai "Raja Asam" karena kemampuannya untuk mengalirkan proton, sehingga sangat kuat dalam mengionisasi dalam larutan.
Asam sulfat juga sangat larut dalam air, yang membuatnya mudah untuk digunakan dalam berbagai aplikasi industri dan laboratorium. Namun, sifat korosifnya juga membuatnya sangat berbahaya dan harus ditangani dengan hati-hati.
Selain itu, asam sulfat juga memiliki karakteristik non-volatil, yang berarti asam ini tidak mudah menguap dalam suhu kamar sehingga tidak menghasilkan uap yang bisa dihirup. Namun, ketika dipanaskan, asam sulfat dapat mengeluarkan uap yang berbahaya bagi kesehatan manusia.
Oleh karena itu, dalam penggunaannya, asam sulfat harus dihindari dari kontak langsung dengan kulit, mata, dan pernapasan, serta harus disimpan dengan aman dan sesuai dengan aturan keselamatan yang berlaku.
Manfaat Asam Sulfat
Asam sulfat memiliki beragam manfaat yang sangat penting dalam berbagai industri.
Pertama-tama, asam sulfat digunakan dalam produksi pupuk, dimana asam sulfat bereaksi dengan batuan fosfat untuk menghasilkan asam fosfat, yang merupakan bahan utama dalam pembuatan pupuk fosfat.
Selain itu, asam sulfat juga digunakan dalam industri baja, dimana asam sulfat membantu dalam proses produksi baja dengan membantu menghilangkan oksida besi dari permukaan baja.
Asam sulfat juga digunakan dalam proses penyamakan kulit dan dalam pembuatan baterai timbal.
Dengan demikian, asam sulfat memiliki peran penting dalam berbagai industri yang berkontribusi dalam pembuatan pupuk, produksi baja, penyamakan kulit, dan pembuatan baterai timbal.
Ini menunjukkan betapa pentingnya asam sulfat dalam mendukung berbagai kebutuhan manusia dalam berbagai bidang industri.
Bahaya asam sulfat
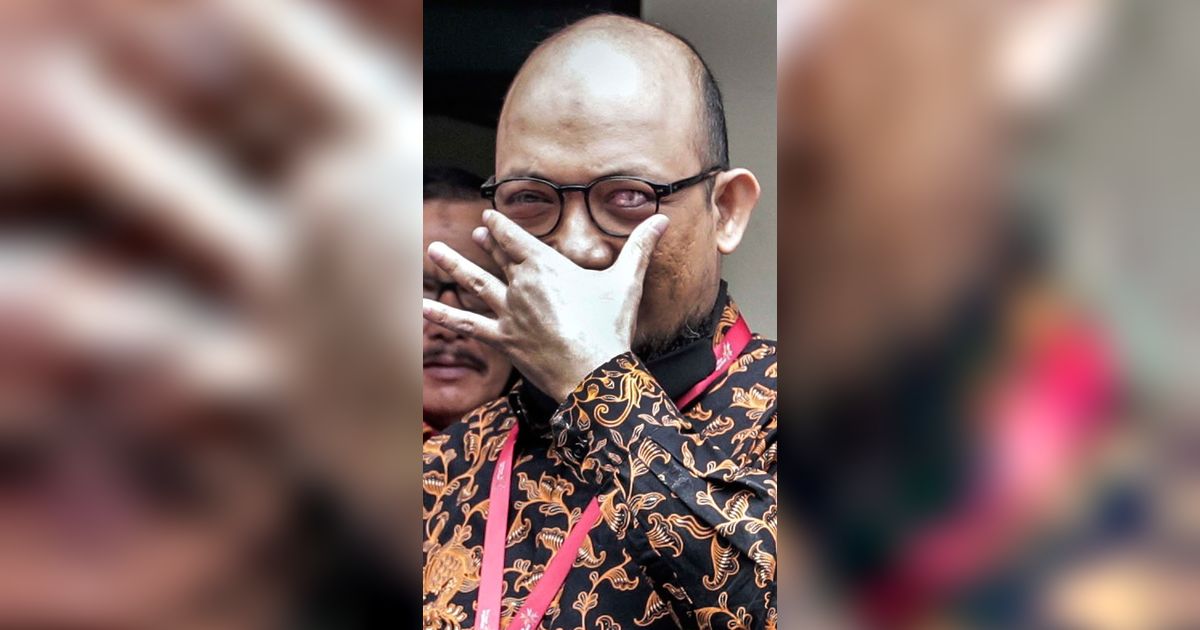
Bahaya asam sulfat sangatlah serius dan berbahaya. Asam sulfat adalah zat kimia yang sangat korosif dan dapat menyebabkan luka bakar pada kulit dan mata jika terkena.
Jika terhirup, asam sulfat juga dapat merusak saluran pernapasan dan menyebabkan kerusakan paru-paru.
Selain itu, asam sulfat juga merupakan zat yang mudah terbakar, sehingga dapat menyebabkan kebakaran yang sulit dikendalikan.
Bahaya ini dapat sangat merugikan, terutama jika terjadi di area yang padat dan sulit dievakuasi.
Asam sulfat juga dapat mencemari lingkungan jika tumpah ke tanah atau air, menyebabkan kerusakan pada ekosistem dan kesehatan manusia. Hal ini dapat berdampak jangka panjang terhadap keberlanjutan lingkungan dan sumber daya alam.
Selain itu, ada beberapa bahaya asam sulfat, antara lain:
Bahaya Kontak Kulit
Luka bakar kimia akibat kontak kulit dengan asam sulfat dapat menyebabkan kerusakan yang serius pada kulit dan jaringan di bawahnya.
Untuk mengatasi luka bakar kimia ini, langkah pertama yang harus dilakukan adalah segera membilas area yang terkena dengan air mengalir selama minimal 15 menit.
Pastikan untuk tidak menggunakan obat-obatan atau minyak saat membersihkan luka bakar, karena hal ini dapat memperparah kerusakan. Setelah proses membersihkan area yang terkena, segera cari bantuan medis untuk perawatan lebih lanjut.
Membiarkan luka bakar kimia akibat asam sulfat tanpa penanganan medis yang tepat dapat menyebabkan komplikasi serius, seperti infeksi atau kerusakan jaringan yang lebih dalam. Oleh karena itu, penting untuk segera mencari bantuan medis jika luka bakar terlihat parah atau jika terdapat tanda-tanda infeksi.
Bahaya Kontak Mata
Kontak dengan asam sulfat dapat menyebabkan bahaya serius pada mata.
Jika mata terkena asam sulfat, segera basuh mata dengan air mengalir selama minimal 15 menit. Hal ini dapat membantu mengurangi efek yang disebabkan oleh asam sulfat pada mata.
Penting untuk mengidentifikasi gejala keracunan asam sulfat pada mata, termasuk nyeri, mata merah, penglihatan kabur, dan iritasi.
Jika Anda atau seseorang mengalami gejala-gejala ini setelah kontak dengan asam sulfat, segera cari bantuan medis. Keracunan asam sulfat pada mata dapat menyebabkan kerusakan mata yang parah jika tidak segera diobati.
Maka dari itu, penting untuk segera merespons kontak dengan asam sulfat pada mata dengan cara membilas mata menggunakan air mengalir selama minimal 15 menit dan segera mencari bantuan medis jika diperlukan.
Bahaya Asam Sulfat Terhirup
Asam sulfat adalah zat kimia yang sangat berbahaya jika terhirup oleh manusia. Terhirupnya asam sulfat bisa menyebabkan iritasi parah pada saluran pernapasan dan mengakibatkan masalah pernapasan yang serius.
Gejala yang mungkin timbul akibat terhirupnya asam sulfat antara lain adalah sesak napas, batuk, sakit tenggorokan, dan iritasi pada mata.
Kondisi serius yang dapat disebabkan oleh inhalasi asam sulfat termasuk pneumonia kimia, kerusakan paru-paru, hingga kerusakan permanen pada saluran pernapasan.